ことの始まり
ホモ・プロテインcDNAバンクの中から、タンパク質間相互作用モチーフとして知られているWWドメインを有し、核内に存在しているNpw38/PQBP1という新規タンパク質について報告しました(K99-3)。続いてNpw38のWWドメインに結合するタンパク質の探索を行い、Proに富む結合モチーフを有するNpwBPを見出しました(K99-7)。ただ、このタンパク質は前年にマウスで部分配列が報告されていたWBP11のオルソログであることからか、現在タンパク質名としてWW domain binding protein 11(WBP11)が採用されています。
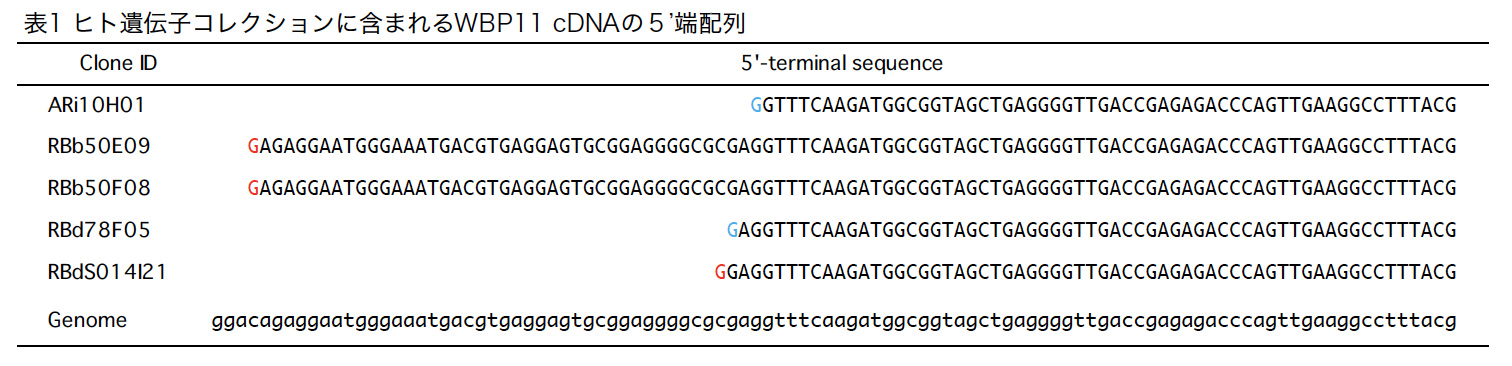
ヒト遺伝子コレクションに含まれるWBP11cDNA
WBP11を見つけた時点で、当時の手持ちのcDNAクローンの中にWBP11をコードするcDNAは含まれていなかったので、ESTデータベース検索で見つかった神経上皮由来のESTクローンを取り寄せて用いました。我々のヒト遺伝子コレクションには、ARPE-19細胞株から得られた1個、Y79細胞株から得られた4個のWBP11完全長cDNAクローンが含まれています(HP00169)。各クローンの5’端部分塩基配列をゲノムの配列とともに表1に示します。いずれもGから始まることから完全長cDNAクローンであることがわかります。RBb50E09とRBb50F08は近接していることから、同一クローンと思われます。また、これらは他のクローンに比べ転写開始点が上流にあります。
WBP11cDNAのクローニング
ヒトWBP11の完全長cDNAを取得し報告したのは我々が最初です。前年、ハーバード大のBedfordらはファーウェスタンスクリーニング法によってマウスFBP21のWWドメインと結合するタンパク質をコードするマウス短縮cDNAを報告しています[1] 。このcDNAはNpwBPの214番目のMetから599番目のArgまでの配列と類似した配列を有していますが、データベースに登録しただけで、それ以上の解析は行われていません。Metから始まるのでデータベースにはcomplete cdsとして登録されています(AF071186)が、このMetは開始コドンによるものではありません。
2001年、イギリスのYamanouchi研究所のCraggsらがp47phox(Neutrophil cytosolic factor 1)のSH3ドメインとGSTとの融合タンパク質GST-SH3と結合するタンパク質をNamalwa細胞から精製し、SNP70と命名したタンパク質を得ました[2]。ペプチド断片のアミノ酸配列を用いてESTデータベースを検索してEST断片を取得し、5’-PCR-RACEによって5’端の配列を得ました。得られた配列はNpwBPと同一でしたが、この時点でまだ我々の論文が出ておらず論文の中ではSNP70という名前で通し、Discussionの中でNpwBPと同一であることに触れ、それ以降、SNP70/NpwBPと表記しています。我々の論文が先に出たのでかなり焦ったのではないかと思われます。
2004年、スペインのカンタブリア大のLlorianらが、プロテインホスファターゼー1(PP1)と結合するタンパク質をマウス胚MATCHMAKER cDNAライブラリーを用いて酵母2ハイブリッドスクリーニングを行ったところ、NpwBPと同一タンパク質が得られました[3]。このタンパク質がpre-mRNAスプライシングファクターとして機能することからSIPP1(Splicing factor that interacts with PQBP-1 and PP1)と命名しています。
WBP11の構造
図1にWBP11のドメイン構造を、図2にWBP11のプロテオグラムを示します。WBP11は22番目から37番目までの核局在化シグナル(NLS)、191番目から209番目までのProに富む領域、231番目から301番目までのAspとGluに富む酸性アミノ酸残基領域、341番目から381番目までのAspとGluに富む酸性アミノ酸残基領域、405番目から538番目までのProに富む領域という5つのドメインが特徴的です。他にも3箇所のNLS候補領域があります。
図1 WBP11のドメイン構造
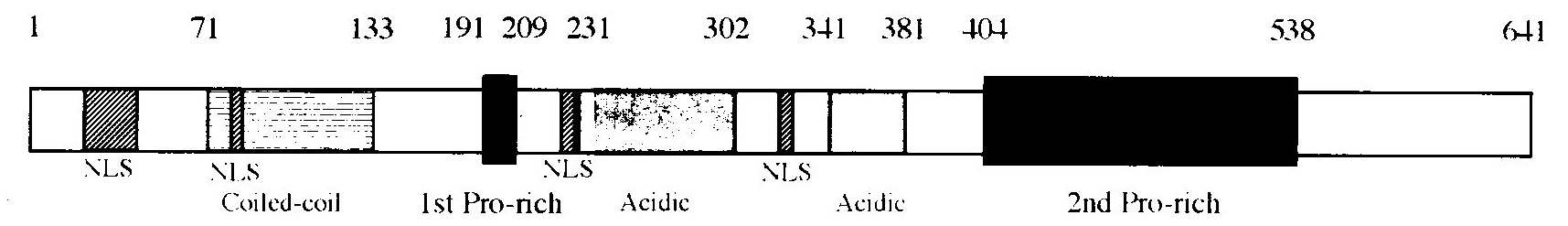
図2 WBP11のプロテオグラム
WBP11の機能
次に示すような各種実験結果からWBP11はスプライセオソーム複合体の一員としてスプライシングに関与している可能性が示唆されています。
- WBP11は核から抽出の際RNase Aによって溶出されるのでRNAと結合しており、免疫染色の結果SC35やU2B”と共局在する[2]。
- WBP11は核に出入りするシャトルタンパク質であり、核内に入って濃度依存的にpre-mRNAスプライシングを活性化する[4]。
- WBP11のProリッチモティーフは、スプライセオソーム複合体の一部であるU5-52KのGYFドメインと結合する[5]。
- スプライセオソームA複合体を精製し質量分析法で解析した結果、Npw38とNpwBPが含まれている[6]。
- FBP21を発現させるとスプライシングが活性化し、核内でSC35と共局在するFBP21の2個の直列WWドメインはWBP11のProリッチ領域に結合する[7]。
- アフリカツメガエル胚でPQBP1かWBP11のいずれかをノックダウンするとfgf4の発現を阻害し、fgfr2の選択的スプライシングに影響する[8]。
- PQBP1のCTDに対するU5-15Kの結合は、PQBP1へのWBP11の結合によるアロステリック効果により抑制される[9]。
- WBP11は中心小体の複製に必要であり、WBP11の欠損はγ-TuRCの中心的構成要素であるTUBGCP6のスプライシング異常を引き起こす[10]。
- WBP11と結合するC5orf22が欠損すると、細胞増殖や免疫調節に関わる遺伝子のスプライシングや発現に異常が生じる[11]。
- WBP11はp53のCTDに結合し、p53標的遺伝子の発現や選択的スプライシングを制御している[12]。
スプライシングとは直接関係ありませんが、WBP11が核内のスペックル以外に核の周囲の中間径フィラメントビメンチンと共局在していることが示されています[2]。
WBP11は上記のように数多くのタンパク質と相互作用することが明らかになっています。WBP11の機能を知るには、これらのタンパク質がいつどの部位に結合するかを知ることが必要になりますが、この問題を解決するには新しい技術が必要と思われます。
WBP11が関与する疾患
癌との関連では、次のような報告があります。
- 細胞遊走誘導タンパク質KIAA1199は、WBP11と結合してE-カドヘリンとN-カドヘリンの発現を制御し、胃がんでは過剰発現し転移に関与する[13]。
- 大腸癌の疾患転帰にWBP11のSNPが関連する[14]。
- WBP11は膀胱癌細胞で高発現し、膀胱癌細胞の生存に必須なクルッペル様因子16(KLF16)のmRNAが二重特異性ホスファターゼ16(DUSP16)のmRNAとWBP11と競合的に結合し、DUSP16 mRNAの不安定化を引き起こす[15]。
遺伝病との関連では、次のような報告があります。
- 多重先天奇形の患者に、WBP11のハプロ欠失やミスセンス変異が認められる[16]。
- WBP11のハプロ不全により孤立性先天性脊椎異常とSprengel奇形が起こる[17]。